عطرية مميزة كلاسيكيا. العطرية في الكربوهيدرات. طرق تركيب الدورات الصغيرة
الكيمياء هي قلب العلم. إنها تعزف كل الخطب ، yakі іsnuyuet في الطبيعة ، و їх غير شخصية. تنقسم الرائحة الكريهة إلى غير عضوية وعضوية. في هذا المقال ، من الواضح أنه عطري في الكربوهيدرات التي تقع على عاتق باقي المجموعة.
ما هذا؟
Tse العضوية ، قد يكون لدى yakі في مستودعاتهم واحدة أو عدد قليل من نوى البنزين - هياكل مستقرة من ست ذرات من الكربون ، z'ednah في bagatokutnik. بالنظر إلى التركيب الكيميائي ، هناك رائحة معينة يمكن فهمها من اسمها. في مجموعات الكربوهيدرات ، تعتبر المجموعات دورية ، فوق الألكانات والألكينات وغيرها.
العطرية في الكربوهيدرات. البنزين
هذه أبسط كيمياء لمجموعة الخطب بأكملها. ست ذرات من الكربون والصلب والهيدروجين تدخل إلى مستودع أحد الجزيئات. جميع الكربوهيدرات العطرية الأخرى تشبه البنزين ويمكن إزالتها من هذا المستخلص. خطاب Tsya ، بعقول طبيعية ، يوجد في حالة نادرة ، إنه بدون رأس ، له رائحة عرق سوس معينة ، لا يختلف عن الماء. يبدأ الغليان عند درجة حرارة +80 درجة مئوية ، ويتجمد عند درجة حرارة +5.
القوة الكيميائية للبنزين والهيدروكربونات العطرية الأخرى
أولاً ، من الضروري إحترام - الهالوجين و nіtruvannya.
تفاعلات الاستبدال
الأول їх - الهالوجين. في حالتي ، من أجل حدوث تفاعل كيميائي ، من الضروري تقليب المحفز ، ويكون ثلاثي الكلوريد نفسه مالحًا. بهذه الطريقة ، إذا أضفت الكلور (Cl2) إلى البنزين (C6H6) ، فإننا نأخذ كلوروبنزين (C6H5Cl) وماء الكلور (HCl) ، والذي يظهر في غاز واضح المظهر برائحة نفاذة. لذلك بعد التفاعل ، يتم استبدال ذرة من الماء بذرة كلور. يمكن أن يحدث الشيء نفسه عند إضافة الهالوجينات الأخرى (اليود ، البروم ، إلخ) إلى البنزين. تفاعل استبدال آخر - نترات - يتبع مبدأ مشابهًا. هنا ، يتم لعب دور المحفز بواسطة تركيزات حامض الكبريتيك. لإجراء هذا النوع من التفاعل الكيميائي للبنزين ، من الضروري إضافة حمض النترات (HNO 3) ، والذي يتركز أيضًا ، وبعد ذلك يتم إذابة النيتروبنزين (C 6 H 5 NO 2) والماء. في هذه الحالة ، يتم استبدال ذرة الهيدروجين بمجموعة من ذرة النيتروجين واثنين من الأكسجين.

ردود الفعل قادمة
هذا نوع آخر من التفاعلات الكيميائية ، ينضم الياكو زداتني العطري في الكربوهيدرات. كما أنها تستخدم نوعين: الهالوجين والتحلل المائي. الأول أكثر أهمية لوضوح طاقة سوني ، والتي تلعب دور المحفز. لإجراء التفاعل مع البنزين ، من الضروري أيضًا إضافة الكلور ، والبيرة لكمية أكبر ، وأقل للاستبدال. يمكن أن يكون هناك ثلاثة كلور لكل جزيء من البنزين. ونتيجة لذلك ، يُستخرج سداسي كلورو حلقي الهكسان (C6H6Cl6) ، بحيث تتم إضافة ستة كلور أخرى إلى الذرات الأخيرة.
تقل احتمالية حدوث الهدرجة في وجود النيكل. لذلك من الضروري خلط البنزين والهيدروجين (H 2). نسب من رد الفعل إلى الأمام. بعد ذلك ، يتم إذابة الهكسان الحلقي (Z 6 H 12). يمكن أن تدخل جميع الكربوهيدرات العطرية الأخرى أيضًا في هذا النوع من التفاعل. تتبع الرائحة الكريهة نفس المبدأ ، كما في حالة البنزين ، فقط في اعتماد الخطب المطوية.
حيازة خطابات كيميائية للمجموعة
لنفعل الشيء نفسه مع البنزين. يمكن تناول Yogo كمكمل لمثل هذا الكاشف ، مثل الأسيتيلين (3 2 H 2). من ثلاثة جزيئات من هذا الكلام ، تحت تدفق درجة حرارة عالية ومحفز ، يتم إذابة جزيء واحد من المادة الكيميائية المطلوبة.

أيضا ، يمكن استخدام البنزين والمركبات العطرية الأخرى في الكربوهيدرات مع قطران الفحم ، والذي يستخدم لإنتاج فحم الكوك المعدني. تشتمل هذه الطرق على التولوين ، والأوزون ، والزيلين ، والفينانثرين ، والنفتالين ، والأنثراسين ، والفلورين ، والكريزين ، والديفينيل وغيرها. بالإضافة إلى ذلك ، غالبًا ما توجد خطابات هذه المجموعة من منتجات معالجة الزيت.
كيف يبدو الكيميائيون المختلفون من أرضية ذلك الفصل؟
الستيرين هي موطن أم لا معنى له مع رائحة لطيفة ، عطرة قليلاً في الماء ، تصبح درجة الغليان +145 درجة مئوية. النفثالين عبارة عن كلام بلوري يختلف أيضًا قليلاً في الماء ويذوب عند درجة حرارة +80 درجة ويغلي عند +217. الأنثراسين في العقول العادية هو نفسه كما في رؤية البلورات ، لم يعد البروتين خاليًا من الألم ، ولكن قد يكون zabarvlennya. لا يتم فصل خطاب Tsya إما عن طريق الماء أو في تجار التجزئة العضوية. نقطة الانصهار - +216 درجة مئوية ، نقطة الغليان - +342. يشبه الفينانثرين بلورات لامعة ، مثل rozchinyayutsya أقل في تجار التجزئة العضوية. درجة حرارة الانصهار - +101 درجة ، نقطة الغليان - +340 درجة. الفلور ، كما يوحي اسمه ، يتحول إلى الفلورة. تسي ، مثل الكثير من الخطب الأخرى للمجموعة ، - بلورات bezbarvn ، غير واضحة بالقرب من الماء. نقطة الانصهار - +116 ، نقطة الغليان - +294.

ركود الكربوهيدرات العطرية
البنزين vikoristovuєtsya عندما virobnitstvі barvnikіv yak syrovina. أيضا النبيذ هو zastosovuєtsya ل otrimanny vibukhіvki والمبيدات الحشرية و deyaky likіv. يعتبر الستايرين غير مباشر في إنتاج البوليسترين (البوليسترين) من أجل بلمرة إضافية للكلام. البقاء على نطاق واسع في الحياة اليومية: كمادة دافئة وعازلة للصوت كهربيًا. يساهم النفثالين مثله والبنزين في إنتاج المبيدات الحشرية والبارنيكي والمضادات الحيوية. بالإضافة إلى ذلك ، فاز في الصناعة الكيميائية لاختيار المحاصيل العضوية الغنية. أنثراسين أيضا zastosovuyt في تحضير البارفنيك. يلعب الفلور دور عامل استقرار البوليمر. الفينانترين ، كخطاب أمامي وغني بالكربوهيدرات العطرية الأخرى ، هو أحد مكونات البارين. يستخدم التولوين على نطاق واسع في الصناعة الكيميائية لإنتاج الكلمات العضوية ، وكذلك لامتلاك الاهتزازات.

خصائص تنوع الخطب التي تستخدم للكربوهيدرات العطرية الإضافية
قبل ذلك ، يمكن للمرء أن يرى نواتج التفاعلات الكيميائية للبنزين التي تم فحصها. الكلوروبنزين ، على سبيل المثال ، تاجر تجزئة عضوي ، وهو أيضًا نائب في إنتاج الفينول ومبيدات الآفات والخطابات العضوية. النيتروبنزين هو أحد مكونات عوامل التلميع للمعادن ، ويمكن أن يلعب zastosovuetsya في تحضير بعض البارنيكي والنكهات دور بائع تجزئة وعامل مؤكسد. Hexachlorocyclohexane vikoristovuєtsya مثل القمامة لمكافحة البعوض ، وكذلك في الصناعة الكيميائية. حلقي الهكسان zastosovuyut في علاج lakofarbovyh virobіv ، باستخدام المركبات العضوية الغنية ، في صناعة الأدوية.

فيسنوفوك
بعد قراءة هذا المقال ، يمكنك العثور على visnovka غير التافهة بأن المواد العطرية في الكربوهيدرات يمكن أن يكون لها نفس التركيب الكيميائي ، مما يسمح بدمجها في فئة واحدة. بالإضافة إلى ذلك ، فإن قواهم الفيزيائية والكيميائية متشابهة أيضًا. المظهر المرصع بالنجوم ودرجات حرارة الغليان ونقاط الانصهار لجميع الخطابات الكيميائية لهذه المجموعة ليست منزعجة بشدة. يمكنك أن تجد تراكماتك الخاصة من الكربوهيدرات الغنية بالنكهات العطرية في نفس الأماكن الصناعية. الكلام ، يمكن أن تأخذ yakі في الاعتبار تفاعلات الهالوجين والنترة والهدرجة أيضًا قد يكون لها قوى مماثلة وتنتصر في أغراض مماثلة.
عطرية- قوى الغناء Podnannya ، قوة المجموعة الكبيرة من الأفواج ، الألقاب ، من الواضح أنها عطرية.
تم تقديم مصطلح "العطرية" في عام 1865 من قبل ف. كيكول ، الذي قدم البنزين واقترح الصيغة:
يرجع الاسم "العطري" إلى حقيقة أنه في منتصف الماضي وجد أن للبنزين رائحة لطيفة (على سبيل المثال ، يمكن أن تكون رائحة النيتروبنزين مثل اللوز).
Kekule بعد أن تخلى عن احترام أولئك الذين لديهم روابط ثانوية في البنزين وبعض من الأخير يتم تذكره لقوة الروابط الثانوية في معظم spoluks غير الموجودة. بالنسبة للبنزين ، من الصعب جدًا الحصول على تفاعل (على سبيل المثال ، الهالوجينات) على طول الروابط السفلية ، والتي يسهل تمريرها في حالة عدم وجود حالات.
الى جانب ذلك ، اتضح أن أورثو- ثنائي كلورو بنزين (توجد ذرات الكلور في ذرتين سوسيدني من الكربون) لا تحتوي على і سومرات ، يمكن تنقية الياك على أساس الصيغة الهيكلية الجديدة ، يتم خلط ذرتين من الكلور إما بطريقة بسيطة أو في الارتباط الفرعي:
نتيجة لذلك ، دفع Kekule لاستدعاء الروابط في البنزين المتذبذبة ، أي أنها غامضة. على مدار العام ، تضخم tse pripuschennya تطورًا بعيدًا ، وتم الانتهاء منه بالكامل.
أكثر التفاعلات المميزة للبنزين هو استبدال الذرات في الماء. أظهرت دراسة كيمياء البنزين أن استبدال ذرة من الماء بمجموعة من الأغاني ، وهي دخان ، مرتبة قيادية ، تضخ الطبيعة الرجعية للذرات الأخرى في الماء.
إذا أدخلت مجموعة في نواة البنزين ، والتي تمتص الإلكترونات من النواة (على سبيل المثال ، الميثيل) ، فانتقل إلى الهالوجين للاستبدال في أورثو-і زوج-أنظمة. مع إدخال مجموعة تغذية الإلكترون (على سبيل المثال ، الكربوكسيل) ، يتم تقويم الهالوجين إلى ميتا-منضدة:
لفترة طويلة ، تم تقييم العطرية من خلال مجموعة من التعيينات للقوى الكيميائية ، وعرفت المزيد والمزيد من العلامات الدقيقة خطوة بخطوة ، بناءً على ملامح مستقبل النباتات العطرية.
تبدو بودوفا الإلكترونية للبنزين وتلك الموجودة في النصف الآخر من اليوم مثل هذا بالنسبة إلى الروماني الحديث. للمشاركة في الروابط التخريبية المستقرة ص- ذرات الإلكترون في الفحم والمدارات (المنطقة ذات أكبر توزيع ممكن للإلكترون في الفضاء) والإلكترونات يمكن أن تشكل شكل الموجات الحجمية. في أوقات البنزين ، تتقاطع المدارات بشكل متبادل ، مما يرضي المدارات الكلسية ، والتي ص- جزيئات الإلكترون:

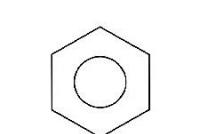
نتيجة لذلك ، تظهر قذيفة إلكترونية واحدة مغلقة ، ويكتسب النظام ثباتًا عاليًا. تثبيت الروابط البسيطة والمعتمدة في البنزين يوميًا ، يتم حساب متوسط جميع روابط C-C ومكافئها ، ومن الشائع استخدام رمز الحلقة لتحديد عطرية النائب ، وموضع الدورة الوسطى:
في المدارات الدورية ، التي استقرت ، هناك مداعبة أوتار الآلة الموسيقية القاسية ، والتي يمكن أن تتجلى من خلال vimirami خاص ، والذي يشير بالإضافة إلى ذلك إلى عطرية اليوم.
يمكن أن تكون العطرية جزيئات دائرية مستوية ، مع عدد الإلكترونات ( م) ، مجتمعة في نظام دوري واحد ، قد تتبع قاعدة Hückel:
م = 4ن + 2 (ن = 0, 1, 2, 3...), ن- عدد السلاسل الطبيعية
فيما يلي عرض أول ثلاثة ممثلين لهذه السلسلة من الجزيئات العطرية ، والتي تتوافق مع قاعدة Hückel: كاتيون السيكلوبروبين ، والبنزين والنفتالين.
أتاح توسيع مفهوم "العطرية" أن يمتد المصطلح إلى النوع غير البنزين ، ولكن في نفس الوقت ، مع مجموعة من السمات الهيكلية والكيميائية المميزة للبنزين المماثل.
في بعض النباتات ، حيث تشتمل الدورة على ذرات O أو S أو N ، على سبيل المثال ، في فوران ، ثيوفين ، بيرول هو نفسه كما هو الحال في البنزين ، فإن st_yka الرئيسي - على غرار قاعدة Hückel - نظام مغلق بستة إلكترونات. شوتيري ص-الإلكترون (المميز باللون الأزرق على الصغير) لإعطاء روابط سلسلة للدورة ، واثنين س-الإلكترون (المميز باللون الأحمر) لإعطاء الذرة والحمض ، سيركي للنيتروجين ، لإعطاء زوج غير مناسب من الإلكترونات.
ميخائيلو ليفيتسكي
الكيمياء هي قلب العلم. إنها تعزف كل الخطب ، yakі іsnuyuet في الطبيعة ، و їх غير شخصية. تنقسم الرائحة الكريهة إلى غير عضوية وعضوية. في هذا المقال ، من الواضح أنه عطري في الكربوهيدرات التي تقع على عاتق باقي المجموعة.
ما هذا؟
Tse العضوية ، قد يكون لدى yakі في مستودعاتهم واحدة أو عدد قليل من نوى البنزين - هياكل مستقرة من ست ذرات من الكربون ، z'ednah في bagatokutnik. بالنظر إلى التركيب الكيميائي ، هناك رائحة معينة يمكن فهمها من اسمها. في مجموعات الكربوهيدرات ، تعتبر المجموعات دورية ، فوق الألكانات والألكينات وغيرها.
العطرية في الكربوهيدرات. البنزين
هذه أبسط كيمياء لمجموعة الخطب بأكملها. ست ذرات من الكربون والصلب والهيدروجين تدخل إلى مستودع أحد الجزيئات. جميع الكربوهيدرات العطرية الأخرى تشبه البنزين ويمكن إزالتها من هذا المستخلص. خطاب Tsya ، بعقول طبيعية ، يوجد في حالة نادرة ، إنه بدون رأس ، له رائحة عرق سوس معينة ، لا يختلف عن الماء. يبدأ الغليان عند درجة حرارة +80 درجة مئوية ، ويتجمد عند درجة حرارة +5.
القوة الكيميائية للبنزين والهيدروكربونات العطرية الأخرى
أولاً ، من الضروري إحترام - الهالوجين و nіtruvannya.
تفاعلات الاستبدال
الأول їх - الهالوجين. في حالتي ، من أجل حدوث تفاعل كيميائي ، من الضروري تقليب المحفز ، ويكون ثلاثي الكلوريد نفسه مالحًا. بهذه الطريقة ، إذا أضفت الكلور (Cl2) إلى البنزين (C6H6) ، فإننا نأخذ كلوروبنزين (C6H5Cl) وماء الكلور (HCl) ، والذي يظهر في غاز واضح المظهر برائحة نفاذة. لذلك بعد التفاعل ، يتم استبدال ذرة من الماء بذرة كلور. يمكن أن يحدث الشيء نفسه عند إضافة الهالوجينات الأخرى (اليود ، البروم ، إلخ) إلى البنزين. تفاعل استبدال آخر - نترات - يتبع مبدأ مشابهًا. هنا ، يتم لعب دور المحفز بواسطة تركيزات حامض الكبريتيك. لإجراء هذا النوع من التفاعل الكيميائي للبنزين ، من الضروري إضافة حمض النترات (HNO 3) ، والذي يتركز أيضًا ، وبعد ذلك يتم إذابة النيتروبنزين (C 6 H 5 NO 2) والماء. في هذه الحالة ، يتم استبدال ذرة الهيدروجين بمجموعة من ذرة النيتروجين واثنين من الأكسجين.

ردود الفعل قادمة
هذا نوع آخر من التفاعلات الكيميائية ، ينضم الياكو زداتني العطري في الكربوهيدرات. كما أنها تستخدم نوعين: الهالوجين والتحلل المائي. الأول أكثر أهمية لوضوح طاقة سوني ، والتي تلعب دور المحفز. لإجراء التفاعل مع البنزين ، من الضروري أيضًا إضافة الكلور ، والبيرة لكمية أكبر ، وأقل للاستبدال. يمكن أن يكون هناك ثلاثة كلور لكل جزيء من البنزين. ونتيجة لذلك ، يُستخرج سداسي كلورو حلقي الهكسان (C6H6Cl6) ، بحيث تتم إضافة ستة كلور أخرى إلى الذرات الأخيرة.
تقل احتمالية حدوث الهدرجة في وجود النيكل. لذلك من الضروري خلط البنزين والهيدروجين (H 2). نسب من رد الفعل إلى الأمام. بعد ذلك ، يتم إذابة الهكسان الحلقي (Z 6 H 12). يمكن أن تدخل جميع الكربوهيدرات العطرية الأخرى أيضًا في هذا النوع من التفاعل. تتبع الرائحة الكريهة نفس المبدأ ، كما في حالة البنزين ، فقط في اعتماد الخطب المطوية.
حيازة خطابات كيميائية للمجموعة
لنفعل الشيء نفسه مع البنزين. يمكن تناول Yogo كمكمل لمثل هذا الكاشف ، مثل الأسيتيلين (3 2 H 2). من ثلاثة جزيئات من هذا الكلام ، تحت تدفق درجة حرارة عالية ومحفز ، يتم إذابة جزيء واحد من المادة الكيميائية المطلوبة.

أيضا ، يمكن استخدام البنزين والمركبات العطرية الأخرى في الكربوهيدرات مع قطران الفحم ، والذي يستخدم لإنتاج فحم الكوك المعدني. تشتمل هذه الطرق على التولوين ، والأوزون ، والزيلين ، والفينانثرين ، والنفتالين ، والأنثراسين ، والفلورين ، والكريزين ، والديفينيل وغيرها. بالإضافة إلى ذلك ، غالبًا ما توجد خطابات هذه المجموعة من منتجات معالجة الزيت.
كيف يبدو الكيميائيون المختلفون من أرضية ذلك الفصل؟
الستيرين هي موطن أم لا معنى له مع رائحة لطيفة ، عطرة قليلاً في الماء ، تصبح درجة الغليان +145 درجة مئوية. النفثالين عبارة عن كلام بلوري يختلف أيضًا قليلاً في الماء ويذوب عند درجة حرارة +80 درجة ويغلي عند +217. الأنثراسين في العقول العادية هو نفسه كما في رؤية البلورات ، لم يعد البروتين خاليًا من الألم ، ولكن قد يكون zabarvlennya. لا يتم فصل خطاب Tsya إما عن طريق الماء أو في تجار التجزئة العضوية. نقطة الانصهار - +216 درجة مئوية ، نقطة الغليان - +342. يشبه الفينانثرين بلورات لامعة ، مثل rozchinyayutsya أقل في تجار التجزئة العضوية. درجة حرارة الانصهار - +101 درجة ، نقطة الغليان - +340 درجة. الفلور ، كما يوحي اسمه ، يتحول إلى الفلورة. تسي ، مثل الكثير من الخطب الأخرى للمجموعة ، - بلورات bezbarvn ، غير واضحة بالقرب من الماء. نقطة الانصهار - +116 ، نقطة الغليان - +294.

ركود الكربوهيدرات العطرية
البنزين vikoristovuєtsya عندما virobnitstvі barvnikіv yak syrovina. أيضا النبيذ هو zastosovuєtsya ل otrimanny vibukhіvki والمبيدات الحشرية و deyaky likіv. يعتبر الستايرين غير مباشر في إنتاج البوليسترين (البوليسترين) من أجل بلمرة إضافية للكلام. البقاء على نطاق واسع في الحياة اليومية: كمادة دافئة وعازلة للصوت كهربيًا. يساهم النفثالين مثله والبنزين في إنتاج المبيدات الحشرية والبارنيكي والمضادات الحيوية. بالإضافة إلى ذلك ، فاز في الصناعة الكيميائية لاختيار المحاصيل العضوية الغنية. أنثراسين أيضا zastosovuyt في تحضير البارفنيك. يلعب الفلور دور عامل استقرار البوليمر. الفينانترين ، كخطاب أمامي وغني بالكربوهيدرات العطرية الأخرى ، هو أحد مكونات البارين. يستخدم التولوين على نطاق واسع في الصناعة الكيميائية لإنتاج الكلمات العضوية ، وكذلك لامتلاك الاهتزازات.

خصائص تنوع الخطب التي تستخدم للكربوهيدرات العطرية الإضافية
قبل ذلك ، يمكن للمرء أن يرى نواتج التفاعلات الكيميائية للبنزين التي تم فحصها. الكلوروبنزين ، على سبيل المثال ، تاجر تجزئة عضوي ، وهو أيضًا نائب في إنتاج الفينول ومبيدات الآفات والخطابات العضوية. النيتروبنزين هو أحد مكونات عوامل التلميع للمعادن ، ويمكن أن يلعب zastosovuetsya في تحضير بعض البارنيكي والنكهات دور بائع تجزئة وعامل مؤكسد. Hexachlorocyclohexane vikoristovuєtsya مثل القمامة لمكافحة البعوض ، وكذلك في الصناعة الكيميائية. حلقي الهكسان zastosovuyut في علاج lakofarbovyh virobіv ، باستخدام المركبات العضوية الغنية ، في صناعة الأدوية.

فيسنوفوك
بعد قراءة هذا المقال ، يمكنك العثور على visnovka غير التافهة بأن المواد العطرية في الكربوهيدرات يمكن أن يكون لها نفس التركيب الكيميائي ، مما يسمح بدمجها في فئة واحدة. بالإضافة إلى ذلك ، فإن قواهم الفيزيائية والكيميائية متشابهة أيضًا. المظهر المرصع بالنجوم ودرجات حرارة الغليان ونقاط الانصهار لجميع الخطابات الكيميائية لهذه المجموعة ليست منزعجة بشدة. يمكنك أن تجد تراكماتك الخاصة من الكربوهيدرات الغنية بالنكهات العطرية في نفس الأماكن الصناعية. الكلام ، يمكن أن تأخذ yakі في الاعتبار تفاعلات الهالوجين والنترة والهدرجة أيضًا قد يكون لها قوى مماثلة وتنتصر في أغراض مماثلة.
القوة البدنية
البنزين واليوغا هما أقرب المتجانسات - رائحة خاصة للبيزبارفني روديني زل. الكربوهيدرات العطرية خفيفة في الماء ولا تنفصل في الماء ، ويمكن فصل البروتين بسهولة في المصادر العضوية - الكحول ، الأثير ، الأسيتون.
يعتبر متماثلو البنزين واليوغا أنفسهم تجار تجزئة جيدين للخطب العضوية الغنية. تحترق جميع الساحات بأضواء نصف مدخنة عبر المكان المرتفع للكربون في جزيئاتها.
يتم عرض القوى المادية لهذه الساحات في الجداول.
جدول. الهيمنة المادية لهذه الساحات
|
اسم |
معادلة |
t ° .pl. ، |
t ° .bp. ، |
|
البنزين |
ج 6 ح 6 |
5,5 |
80,1 |
|
التولوين (ميثيل بنزين) |
Z 6 N 5 CH 3 |
95,0 |
110,6 |
|
إيثيل بنزين |
W 6 H 5 W 2 H 5 |
95,0 |
136,2 |
|
زيلين (ثنائي ميثيل بنزين) |
Z 6 H 4 (CH 3) 2 |
||
|
أورثو- |
25,18 |
144,41 |
|
|
ميتا |
47,87 |
139,10 |
|
|
زوج- |
13,26 |
138,35 |
|
|
بروبيل بنزين |
Z 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
كومين (أيزوبروبيل بنزين) |
ج 6 H 5 CH (CH 3) 2 |
96,0 |
152,39 |
|
ستايرين (فينيل بنزين) |
Z 6 H 5 CH \ u003d CH 2 |
30,6 |
145,2 |
البنزين - سهل الغليان ( رستوس\ u003d 80.1 درجة مئوية) ، وطن بلا حواف ، لا يختلف بالقرب من الماء
احترام! البنزين - otruta ، dіє nirki ، تغيير تركيبة الدم (بالتسريب ثلاثي التكافؤ) ، يمكن أن يضر بنية الكروموسومات.
معظم الكربوهيدرات العطرية غير آمنة للحياة وسامة.
حيازة أرينيف (متجانسات البنزين واليوغا)
في المختبر
1. انصهار أملاح حمض البنزويك من المروج الصلبة
C 6 H 5 -COONa + هيدروكسيد الصوديوم ر →ج 6 H 6 + Na 2 CO 3
بنزوات الصوديوم
2. تفاعل Wurtz-Fitting: (هنا G هو هالوجين)
ض 6ح 5 -G + 2نا + ص-G →ج 6 ح 5 - ص + 2 ناجي
دبليو 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
في الصناعة
- انظر من النفتيت والفوجيل بطريقة التقطير التجزيئي ، الإصلاح ؛
- من قطران الفحم وغاز أفران الكوك
1. نزع الماء من الألكاناتبعدد ذرات كربون أكثر من 6:
ج 6 ح 14 ر , كات→ C 6 H 6 + 4H 2
2. Trimerization إلى الأسيتيلين(للبنزين فقط) - نار. زيلينسكي:
3 ج 2 H2 600 درجةج، فعل. فوجيليا→ ج 6 ح 6
3. تجفيفمتماثلات الهكسان الحلقي واليوغا:
بعد أن أثبت الأكاديمي الراديانسكي ميكولا دميتروفيتش زيلينسكي أن البنزين يتحلل من الهكسان الحلقي (نزع الهيدروجين من الألكانات الحلقية
ج 6 ح 12 ر ، قطة→ C 6 H 6 + 3H 2

C 6 H 11 -CH 3 ر , كات→ C 6 H 5 -CH 3 + 3H 2
ميثيل سيكلوهكسانيتولوين
4. الألكلة للبنزين(متجانسات Ottrimannya في البنزين) - فريدل كرافتس.
C 6 H 6 + C 2 H 5-Cl ر ، AlCl3→ C 6 H 5-C 2 H 5 + حمض الهيدروكلوريك
كلورو إيثان إيثيل بنزين

القوة الكيميائية للساحات
أنا. تفاعلات الأكسدة
1. الغورينية (مدخن نصف خفيف):
2ج 6 H 6 + 15O 2 ر→ 12CO 2 + 6H 2 O + Q
2. البنزين ، بالنسبة لأبرز العقول ، لا يتفاعل مع ماء البروم والمحلول المائي لبرمنجنات البوتاسيوم
3. تتأكسد متجانسات البنزين بواسطة برمنجنات البوتاسيوم (تقليل برمنجنات البوتاسيوم):
أ) في الوسط الحمضي لحمض البنزويك
عند حقنها في متجانسات البنزين وبرمنجنات البوتاسيوم وغيرها من المؤكسدات القوية ، تتأكسد الرماح. مثل ثنائي ، نحن لا نطوي أحرف رمح الشفيع ، بل ننهار ، لأن بريق الذرة الأول يتحد ، والذي يتأكسد في مجموعة كربوكسيل.
تعطي متجانسات البنزين مع رمح جانبي حمض البنزويك:
المتماثلون الذين ينتقمون من رمحتين ، يعطون أحماض ثنائية القاعدة:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
طلبت :
ج 6 H 5 -CH 3 + 3O KMnO4→ C 6 H 5 COOH + H 2 O
ب) متعادلة ومنخفضة القيمة لأملاح حمض البنزويك
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K ВІН + 2MnO 2 + H 2 O
ثانيًا. وصول رد الفعل (مهم ، أقل في الألكينات)
1. الهالوجين
ج 6 H 6 + 3Cl 2 ح ν → C 6 H 6 Cl 6 (سداسي كلورو حلقي الهكسان - سداسي كلوران)
2. الترطيب
ج 6 س 6 + 3 س 2 ر , نقطةأوني→ ج 6 ح 12 (سيكلوهكسان)
3. البلمرة
ثالثا. تفاعلات الاستبدال - آلية أيونية (أفتح ، أقل للألكانات)
1. الهلجنة -
أ ) البنزين
ج 6 H 6 + Cl 2 AlCl 3 → C 6 H 5 -Cl + حمض الهيدروكلوريك (كلوروبنزين)
ج 6 H 6 + 6 كلوريد 2 ر ، AlCl3→ C 6 كل 6 + 6 هيدروكلورايد( سداسي كلور البنزين)
ج 6 ح 6 + فرع 2 ر ، فيكل 3→ C 6 H 5 -Br + HBr( بروموبنزين)
ب) متماثلات البنزين أثناء البروز أو التسخين
لجذور الألكيل للطاقة الكيميائية تشبه الألكانات. يتم استبدال ذرات الماء في بعضها بالهالوجين بآلية الجذور الحرة. لذلك ، فإن وجود المحفز أثناء التسخين أو البروز فوق البنفسجي هو تفاعل استبدال جذري في الرمح الأزرق. حقن حلقة البنزين على مدافعات الألكيل مسببة من قبل يتم دائمًا استبدال ذرة الماء بذرة الكربون ، والتي ترتبط ارتباطًا مباشرًا بحلقة البنزين (ذرة الكربون أ).
1) C 6 H 5 -CH 3 + Cl 2 ح ν → C 6 H 5 -CH 2 -Cl + حمض الهيدروكلوريك
ج) متماثلات للبنزين في وجود محفز
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (سوميش أورتو ، زوجان من الفقراء) + حمض الهيدروكلوريك
2. النترات (مع حامض النيتريك)
ج 6 H 6 + HO-NO 2 ر ، H2SO4→ C 6 H 5 -NO 2 + H 2 O
نيتروبنزين - رائحة جفن!
C 6 H 5 -CH 3 + 3H O-NO 2 ر ، H2SO4→ دبليو H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2،4،6-ثلاثي نيتروتولوين (تول ، تروتيل)
ركود متماثلات البنزين واليوغا
البنزينج 6 ح 6 - بائع تجزئة جيد. البنزين هو مادة مضافة تعمل على تحسين جودة حريق المحرك. بمثابة سيروفين لاختيار المركبات العضوية العطرية الغنية - نيتروبنزين C 6 H 5 NO 2 (تاجر تجزئة ، مع الأنيلين) ، كلوروبنزين C 6 H 5 Cl ، الفينول C 6 H 5 OH ، الستايرين ، إلخ.
التولوين C 6 H 5 -CH 3 - بائع تجزئة ، vikoristovuetsya في إنتاج خطابات barniki ، وخطب طبية و vibukhovy (trotyl (tol) ، أو 2،4،6-trinitrotoluene TNT).
زيلينج 6 H 4 (CH 3) 2. الزيلين الفني - مجموع ثلاثة أيزومرات ( أورثو-, ميتا- І زوج-xylolіv) - zastosovuєtsya كتاجر تجزئة ومنتج لتخليق المركبات العضوية الغنية.
ايزوبروبيل بنزينيعمل C 6 H 5 -CH (CH 3) 2 على إزالة الفينولات من الأسيتون.
الكلور البنزينغمزة ل zahistu روزلين. وبالتالي ، فإن ناتج استبدال ذرات الهيدروجين في البنزين بذرات الكلور هو سداسي كلور البنزين C 6 Cl 6 - مبيد فطريات ؛ yogo zastosovuyt للمعالجة الجافة للقمح والجاودار ضد السخام الصلب. ناتج إضافة الكلور إلى البنزين هو سداسي كلورو حلقي الهكسان (سداسي كلوران) С6Н6Сl6 - مبيد حشري ؛ yogo vikoristovuyut للقتال مع z shkіdlivami komakhami. يمكن إرجاع أسرار الكلام إلى مبيدات الآفات - الوسائل الكيميائية لمكافحة الكائنات الحية الدقيقة ، والوردي والمخلوقات.
ستيرين C 6 H 5 - CH \ u003d CH 2 هو أيضًا سهل بلمرة ، وإخماد البوليسترين ، وبلمرة مع مطاط بوتادين - ستيرين بوتادين.
تسليم الفيديو
لكنريني
العطرية في الكربوهيدرات (أريني) - الدورية في الكربوهيدرات ، والتي تُفهم من خلال فهم العطرية ، والتي تعد أهم علامات القوة المستقبلية والكيميائية.
تصنيف
بالنسبة لعدد حلقات البنزين ، تنقسم جزيئات الحلبةعلى ال:
أحادي النواة
نووي غني

التسمية والايزومرية
سلف إنشائي في الكربوهيدرات من سلسلة البنزين البنزين Z 6 H 6في هذه الحالة سيتم إعطاء أسماء متجانسة منهجية.
بالنسبة للحالات أحادية الحلقة ، يتم أخذ هذه الأسماء غير المنتظمة (التافهة):

يشار إلى مواضع الشفعاء بالأرقام الأصغر (لا يمكن أن يكون الترقيم المباشر كبيرًا) ،
|
|
|
ولبدائل اليوم ، يمكنك الفوز بالتعيين أورثو ميتا, زوج.
|
|
|
|
بالنسبة إلى kіlts ، يمكن لثلاثة شفعاء أن يأخذوا أصغر عدد ، أي. يمكن أن يكون للصف "1،2،4" الأسبقية على "1،3،4".


1،2-ثنائي ميثيل-4-إيثيل بنزين (اسم اختياري) 3،4-ثنائي ميثيل-1-إيثيل بنزين (اسم غير صالح)
يتم حواف أيزومريا أحاديات البدائل في arenes بالهيكل الكربوني للحامي ، في تعدد البدائل من متماثلات البنزين ، تتم إضافة المزيد من التماثل ، viklikan إلى roztashuvannyam المختلفة للبدائل في النواة.
ايزومرية الهيدروكربونات العطرية في المستودع Z 9 N 12:
|
|
|
|
|
القوة البدنية
درجات حرارة الغليان والذوبان في الساحات أعلى ، وأقل للألكانات ، والألكينات ، والألكينات ، والقطبية المنخفضة ، ولا تختلف في الماء وتختلف جيدًا في الوريدات العضوية غير القطبية. Areni - tseridini أو الكلام القاسي ، والذي يمكن أن يشم روائح معينة. البنزوليت والأرينات المكثفة الغنية سامة ، وتأثيراتها هي قوة مسببة للسرطان. النواتج الوسيطة لأكسدة تكاثف الأرينات في الكائنات الحية هي الإيبوكسيدات ، والتي إما تسبب السرطان بنفسها أو هي سلائف لمواد مسرطنة.
Otrimannya areniv
قد يكون للكمية الكبيرة من الهيدروكربونات العطرية أهمية عملية كبيرة ، وهي تهتز على نطاق صناعي كبير. عدد من الطرق الصناعية لأساسات معالجة الفحم والنفط.
يتكون النفتا من الرتبة الرئيسية للهيدروكربونات الأليفاتية وغير الحلقية ، لتحويل الهيدروكربونات الأليفاتية أو غير الحلقية إلى طرق تفكك عطرية لعطر النافثا ، والقواعد الكيميائية لهذه الأصناف N.D. Zelinskiy ، B.A. كازانسكي.
1. الدوران والجفاف:
2. ميثيل الهيدروجين:

3. يتم فصل متماثلات البنزين عن طريق الألكلة أو الأسيلة مع إضافات أخرى من مجموعة الكاربونيل.
أ) Alkіluvannya لـ Friedel-Crafts:

ب) الأكورديون لمصنوعات فريدل:

4. الحصول على ثنائي الفينيل من أجل تفاعل Wurtz-Fiting:
5. حيازة ثنائي فينيل ميثان بواسطة تفاعل فريدل كرافتس:
بودوف والقوة الكيميائية.
معايير العطرية:
على أساس الدراسات النظرية لهذا التطور التجريبي للأنظمة الدورية ، ثبت أنه شبه عطري ، لكنه قد لا يكون:
- هيكل دائري مسطح ؛
- تم الحصول على نظام إلكترون مغلق يضم جميع ذرات الدورة وينتقم 4n + 2 de n = 0 ، 1 ، 2 ، 3 وهكذا. صيغة Tse formularyuvannya vіdome ، الياك حكم هوكل.تسمح معايير العطرية بتغيير علاقة الأنظمة العطرية بالآخرين. ينتقم البنزين من مجموعة من الإلكترونات π ويتبع قاعدة Hückel عند n = 1.

ما يعطي عطرية:
بغض النظر عن المستوى العالي من عدم الحضانة ، والعطرية نصف شديدة الانحدار تصل إلى درجات حرارة مؤكسدة ثنائية ، فمن المرجح أن تدخل الرائحة الكريهة في تفاعل الاستبدال ، وليس ظهور. نظرًا للطاقة العالية للحصول على نظام الأكسجين العطري (150 كيلو جول / مول) ، فمن الأهمية بمكان أن يشارك في تفاعل الاستبدال ، مما يؤدي إلى الحفاظ على العطرية.
آلية تفاعل الاستبدال الكهربائي في الحلقة العطرية:
القوة الإلكترونية لنظام حلقة البنزين التي تم الحصول عليها π هي أداة يدوية للهجوم بواسطة الكواشف الكهروكيميائية.
كقاعدة عامة ، يتم إنشاء الكواشف الكهروكيميائية في عملية التفاعل لمحفزات إضافية وعقول مماثلة.
E - Y → E + - Y δ - → E + + Y -
تسوية مجمع π.يؤدي هجوم Pochatkov بواسطة electrofil على كآبة الإلكترون للحلقة إلى تنسيق الكاشف مع نظام π واعتماد مجمع من النوع المتلقي المتلقي المسمى مركب π.النظام العطري غير مدمر:

إنشاء مجمع σ.المرحلة المحددة ، التي ينشئ فيها الملف الكهربائي رابطة تساهمية مع ذرة كربون لكتان مكون من إلكترونين في نظام π للحلقة ، والذي يصاحبه انتقال ذرة معينة إلى ذرة كربون sp2-في sp3-الحالة الهجينة والضرر العطري ، يتحول الجزيء إلى carbocation.

استقرار مركب σ. Zdіysnyuєtsya على طول مسار الانقسام إلى σ- معقد البروتون خلف القاعدة المساعدة. بمساعدة إلكترونين في رابطة تساهمية ، والتي تنفتح ، يصبح C - H نظامًا مغلقًا للحلقة ، يجب أن يكون. لوحظ دوران الجزيء في المطحنة العطرية:

تدفق الشفعات على المبنى الرجعي وتوجيه الاستبدال الكهربائي
المدافعون عن قذائف البنزينі يدمرون رباطة جأش الورود π- الكآبة الإلكترونية للبلاد والصوت لتضيف إلى البناء الرجعي للبلاد.
- تزيد الواجهات المانحة للإلكترون (D) من الطاقة الإلكترونية للحلقة وتزيد من قوة الاستبدال الكهروستاتيكي ، لذلك يُطلق على الوسيطات تفعيل.
- الوسيطات التي تسحب الإلكترون (أ) تقلل من قوة الإلكترون للحلقة وتغير سرعة التفاعل ، تسمى التعطيل.