Класичне визначення ароматичності. Ароматичні вуглеводні. Методи синтезу малих циклів
Хімія - дуже цікава наука. Вона вивчає всі речовини, які існують у природі, а їх безліч. Вони поділяються на неорганічні та органічні. У цій статті ми розглянемо ароматичні вуглеводні, які належать до останньої групи.
Що це таке?
Це органічні речовини, які мають у своєму складі одне або кілька бензольних ядер - стійких структур із шести атомів вуглецю, з'єднаних у багатокутник. Дані хімічні сполуки мають специфічний запах, що можна зрозуміти з їхньої назви. Вуглеводні цієї групи відносяться до циклічних, на відміну від алканів, алкінів та ін.
Ароматичні вуглеводні. Бензол
Це найпростіше хімічне з'єднання з цієї групи речовин. До складу його молекул входять шість атомів вуглецю та стільки ж гідрогену. Всі інші ароматичні вуглеводні є похідними бензолу та можуть бути отримані з його використанням. Ця речовина при нормальних умовах знаходиться в рідкому стані, вона безбарвна, має специфічний солодкуватий запах, у воді не розчиняється. Закипати воно починає за температури +80 градусів за Цельсієм, а замерзати — за +5.
Хімічні властивості бензолу та інших ароматичних вуглеводнів
Перше, на що потрібно звернути увагу, - галогенування та нітрування.
Реакції заміщення
Перша їх — галогенування. У цьому випадку, щоб хімічна взаємодія могла здійснитись, потрібно використовувати каталізатор, а саме трихлорид заліза. Таким чином, якщо додати до бензолу (С6Н6) хлор (Cl2), то ми отримаємо хлорбензол (С6Н5Cl) і хлороводень (HCl), який виділиться у вигляді прозорого газу з різким запахом. Тобто внаслідок цієї реакції один атом водню замінюється атомом хлору. Те саме може статися і при додаванні до бензолу інших галогенів (йоду, брому тощо). Друга реакція заміщення – нітрування – проходить за схожим принципом. Тут у ролі каталізатора виступає концентрований розчин сірчаної кислоти. Для проведення такого роду хімічної реакції до бензолу необхідно додати нітратну кислоту (HNO 3), також концентровану, внаслідок чого утворюються нітробензол (C 6 H 5 NO 2) та вода. У цьому випадку атом гідрогену заміщається групою з атома нітрогену та двох оксигенів.

Реакції приєднання
Це другий тип хімічних взаємодій, які здатні вступати ароматичні вуглеводні. Вони також існують двох видів: галогенування та гідрування. Перша відбувається лише за наявності сонячної енергії, що у ролі каталізатора. Для проведення цієї реакції до бензолу також необхідно додати хлор, але у більшій кількості, ніж для заміщення. На одну молекулу бензолу має припадати три хлори. В результаті отримаємо гексахлорциклогексан (С6Н6Cl6), тобто до наявних атомів приєднається ще й шість хлору.
Гідрування відбувається лише у присутності нікелю. Для цього необхідно змішати бензол та гідроген (Н 2). Пропорції ті самі, що й у попередній реакції. Внаслідок цього утворюється циклогексан (З 6 Н 12). Всі інші ароматичні вуглеводні також можуть вступати до такого типу реакції. Вони відбуваються за таким же принципом, як і у випадку з бензолом, тільки з утворенням складніших речовин.
Одержання хімічних речовин цієї групи
Почнемо так само з бензолу. Його можна отримати за допомогою такого реагенту, як ацетилен (З 2 Н 2). З трьох молекул даної речовини під впливом високої температури та каталізатора утворюється одна молекула потрібної хімічної сполуки.

Також бензол та деякі інші ароматичні вуглеводні можна видобути з кам'яновугільної смоли, що утворюється під час виробництва металургійного коксу. До таких способів можна віднести толуол, о-ксилол, м-ксилол, фенантрен, нафталін, антрацен, флуорен, хризен, дифеніл та інші. Крім того, речовини цієї групи часто видобувають із продуктів переробки нафти.
Як виглядають різноманітні хімічні сполуки цього класу?
Стирол є безбарвною рідиною з приємним запахом, малорозчинною у воді, температура кипіння становить +145 градусів за Цельсієм. Нафталін - кристалічна речовина, що також мало розчиняється у воді, плавиться при температурі +80 градусів, а закипає при +217. Антрацен у нормальних умовах також представлений у вигляді кристалів, проте вже не безбарвних, а мають жовте забарвлення. Ця речовина не розчиняється ні у воді, ні в органічних розчинниках. Температура плавлення – +216 градусів за шкалою Цельсія, кипіння – +342. Фенантрен виглядає як блискучі кристали, які розчиняються лише в органічних розчинниках. Температура плавлення – +101 градус, кипіння – +340 градусів. Флуорен, як відомо з назви, здатний до флуоресценції. Це, як і багато інших речовин цієї групи, - безбарвні кристали, нерозчинні у воді. Температура плавлення – +116, закипання – +294.

Застосування ароматичних вуглеводнів
Бензол використовується при виробництві барвників як сировина. Також він застосовується для отримання вибухівки, пестицидів, деяких ліків. Стирол використовують у виробництві полістиролу (пінопласту) за допомогою полімеризації вихідної речовини. Останній широко застосовують у будівництві: як тепло-і звукоізолюючий, електроізоляційний матеріал. Нафталін, як і бензол, бере участь у виробництві пестицидів, барвників, антибіотиків. Крім того, він використовується в хімічній промисловості для отримання багатьох органічних сполук. Антрацен також застосовують у виготовленні барвників. Флуорен грає роль стабілізатора полімерів. Фенантрен, як і попередня речовина та багато інших ароматичних вуглеводнів, — один із компонентів барвників. Толуол широко застосовують у хімічній промисловості для добування органічних речовин, а також для одержання вибухівки.

Характеристика та використання речовин, що видобуваються за допомогою ароматичних вуглеводнів
До таких насамперед можна віднести продукти розглянутих хімічних реакцій бензолу. Хлорбензол, наприклад, є органічним розчинником, також використовується у виробництві фенолу, пестицидів, органічних речовин. Нітробензол є компонентом полірувальних засобів для металу, застосовується при виготовленні деяких барвників та ароматизаторів, може грати роль розчинника та окислювача. Гексахлорциклогексан використовується як отрута для боротьби з комахами-шкідниками, а також у хімічній промисловості. Циклогексан застосовують у виробництві лакофарбових виробів, при отриманні багатьох органічних сполук, у фарамацевтичній галузі промисловості.

Висновок
Прочитавши цю статтю, можна дійти невтішного висновку, що це ароматичні вуглеводні мають однотипну хімічну структуру, що дозволяє об'єднати в один клас сполук. Крім того, їх фізичні та хімічні властивості також дуже схожі. Зовнішній вигляд, температури кипіння та плавлення всіх хімічних речовин цієї групи не сильно відрізняються. Своє застосування багато ароматичних вуглеводнів знаходять в одних і тих же галузях промисловості. Речовини, які можна отримати внаслідок реакцій галогенування, нітрування, гідрування також мають схожі властивості і використовуються в схожих цілях.
АРОМАТИЧНІСТЬ- Поєднання певних властивостей, властивих великій групі сполук, званих, відповідно, ароматичними.
Термін «ароматичність» ввів у 1865 Ф. Кекуле, який встановив будову бензолу і запропонував йому формулу:
Назва «ароматична» пов'язана з тим, що серед похідних бензолу існують сполуки із приємним запахом (наприклад, нітробензол має запах мигдалю).
Кекуле звернув увагу на те, що подвійні зв'язки в бензолі та його похідних помітно відрізняються за властивостями від подвійних зв'язків у більшості ненасичених сполук. Для бензолу вкрай утруднені реакції приєднання (наприклад, галогенів) по подвійним зв'язкам, які у разі ненасичених сполук проходять досить легко.
Крім того, виявилося, що орто-дихлорбензол (атоми хлору знаходяться у двох сусідніх атомів вуглецю) не має ізомерів, які можна було очікувати на основі запропонованої для нього структурної формули, де два атоми хлору розташовані або у простому, або у подвійному зв'язку:
У результаті Кекуле запропонував назвати зв'язки в бензолі осцилюючими, тобто такими, що вагаються. Згодом це припущення набуло подальшого розвитку, і було вдосконалено.
Найбільш характерні для бензолу реакції заміщення атомів водню. Вивчення хімії бензолу показало, що заміна атома водню на будь-яку групу певним і, головне, передбачуваним чином впливає реакційну здатність інших атомів водню.
Якщо в бензольне ядро ввести групу, що відтягує електрони від ядра (наприклад, метильну), то наступне галогенування призводить до заміщення в орто-і пара-положенні. При введенні електроноподавальної групи (наприклад, карбоксильної) галоген спрямовується в мета-становище:
Довгий час ароматичністю вважали набір зазначених хімічних властивостей, але поступово знайшли більш точні ознаки, засновані на особливостях будови ароматичних сполук.
Електронна будова бензолу та споріднених йому сполук у сучасному розумінні виглядає так. В утворенні подвійних зв'язків беруть участь р-Електрони атомів вуглецю, орбіталі (область найбільш ймовірного розташування електрона в просторі) цих електронів мають форму об'ємних вісімок. У разі бензолу орбіталі взаємоперекриваються, утворюючи кільцеві орбіталі, на яких розташовуються всі р-електрони молекули:

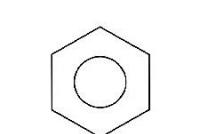
В результаті з'являється єдина замкнута електронна оболонка, система набуває високої стабільності. Фіксовані прості та подвійні зв'язки в бензолі відсутні, всі зв'язки С–С усереднені та еквівалентні, тому найчастіше для позначення ароматичності використовують кільцевий символ, поміщений усередині циклу:
У циклічних орбіталях, що утворилися, виникає кільцевий струм, який може бути виявлений спеціальними вимірами, що додатково вказують на ароматичність з'єднання.
Ароматичність мають плоскі циклічні молекули, при цьому кількість електронів ( m), об'єднаних в єдину циклічну систему, має відповідати правилу Хюккеля:
m = 4n + 2 (n = 0, 1, 2, 3...), n- Число натурального ряду
Нижче показані перші три представники цього ряду ароматичних молекул, що відповідають правилу Хюккеля: катіон циклопропену, бензол та нафталін.
Розширення поняття «ароматичність» дозволило застосувати цей термін до з'єднань небензольного типу, але в той же час, що володіє набором структурних і хімічних ознак, характерних для похідних бензолу.
У деяких з'єднаннях, де до складу циклу входять атоми O, S або N, наприклад, у фурані, тіофені, піролі так само, як у бензолі, існує стійка – відповідно до правила Хюккеля – шестиелектронна замкнута система. Чотири р-електрона (позначені на малюнку синім кольором) надають подвійні зв'язки циклу, а два s-електрона (позначені червоним кольором) дають атоми кисню, сірки чи азоту, мають неподілену пару електронів.
Михайло Левицький
Хімія - дуже цікава наука. Вона вивчає всі речовини, які існують у природі, а їх безліч. Вони поділяються на неорганічні та органічні. У цій статті ми розглянемо ароматичні вуглеводні, які належать до останньої групи.
Що це таке?
Це органічні речовини, які мають у своєму складі одне або кілька бензольних ядер - стійких структур із шести атомів вуглецю, з'єднаних у багатокутник. Дані хімічні сполуки мають специфічний запах, що можна зрозуміти з їхньої назви. Вуглеводні цієї групи відносяться до циклічних, на відміну від алканів, алкінів та ін.
Ароматичні вуглеводні. Бензол
Це найпростіше хімічне з'єднання з цієї групи речовин. До складу його молекул входять шість атомів вуглецю та стільки ж гідрогену. Всі інші ароматичні вуглеводні є похідними бензолу та можуть бути отримані з його використанням. Ця речовина при нормальних умовах знаходиться в рідкому стані, вона безбарвна, має специфічний солодкуватий запах, у воді не розчиняється. Закипати воно починає за температури +80 градусів за Цельсієм, а замерзати — за +5.
Хімічні властивості бензолу та інших ароматичних вуглеводнів
Перше, на що потрібно звернути увагу, - галогенування та нітрування.
Реакції заміщення
Перша їх — галогенування. У цьому випадку, щоб хімічна взаємодія могла здійснитись, потрібно використовувати каталізатор, а саме трихлорид заліза. Таким чином, якщо додати до бензолу (С6Н6) хлор (Cl2), то ми отримаємо хлорбензол (С6Н5Cl) і хлороводень (HCl), який виділиться у вигляді прозорого газу з різким запахом. Тобто внаслідок цієї реакції один атом водню замінюється атомом хлору. Те саме може статися і при додаванні до бензолу інших галогенів (йоду, брому тощо). Друга реакція заміщення – нітрування – проходить за схожим принципом. Тут у ролі каталізатора виступає концентрований розчин сірчаної кислоти. Для проведення такого роду хімічної реакції до бензолу необхідно додати нітратну кислоту (HNO 3), також концентровану, внаслідок чого утворюються нітробензол (C 6 H 5 NO 2) та вода. У цьому випадку атом гідрогену заміщається групою з атома нітрогену та двох оксигенів.

Реакції приєднання
Це другий тип хімічних взаємодій, які здатні вступати ароматичні вуглеводні. Вони також існують двох видів: галогенування та гідрування. Перша відбувається лише за наявності сонячної енергії, що у ролі каталізатора. Для проведення цієї реакції до бензолу також необхідно додати хлор, але у більшій кількості, ніж для заміщення. На одну молекулу бензолу має припадати три хлори. В результаті отримаємо гексахлорциклогексан (С6Н6Cl6), тобто до наявних атомів приєднається ще й шість хлору.
Гідрування відбувається лише у присутності нікелю. Для цього необхідно змішати бензол та гідроген (Н 2). Пропорції ті самі, що й у попередній реакції. Внаслідок цього утворюється циклогексан (З 6 Н 12). Всі інші ароматичні вуглеводні також можуть вступати до такого типу реакції. Вони відбуваються за таким же принципом, як і у випадку з бензолом, тільки з утворенням складніших речовин.
Одержання хімічних речовин цієї групи
Почнемо так само з бензолу. Його можна отримати за допомогою такого реагенту, як ацетилен (З 2 Н 2). З трьох молекул даної речовини під впливом високої температури та каталізатора утворюється одна молекула потрібної хімічної сполуки.

Також бензол та деякі інші ароматичні вуглеводні можна видобути з кам'яновугільної смоли, що утворюється під час виробництва металургійного коксу. До таких способів можна віднести толуол, о-ксилол, м-ксилол, фенантрен, нафталін, антрацен, флуорен, хризен, дифеніл та інші. Крім того, речовини цієї групи часто видобувають із продуктів переробки нафти.
Як виглядають різноманітні хімічні сполуки цього класу?
Стирол є безбарвною рідиною з приємним запахом, малорозчинною у воді, температура кипіння становить +145 градусів за Цельсієм. Нафталін - кристалічна речовина, що також мало розчиняється у воді, плавиться при температурі +80 градусів, а закипає при +217. Антрацен у нормальних умовах також представлений у вигляді кристалів, проте вже не безбарвних, а мають жовте забарвлення. Ця речовина не розчиняється ні у воді, ні в органічних розчинниках. Температура плавлення – +216 градусів за шкалою Цельсія, кипіння – +342. Фенантрен виглядає як блискучі кристали, які розчиняються лише в органічних розчинниках. Температура плавлення – +101 градус, кипіння – +340 градусів. Флуорен, як відомо з назви, здатний до флуоресценції. Це, як і багато інших речовин цієї групи, - безбарвні кристали, нерозчинні у воді. Температура плавлення – +116, закипання – +294.

Застосування ароматичних вуглеводнів
Бензол використовується при виробництві барвників як сировина. Також він застосовується для отримання вибухівки, пестицидів, деяких ліків. Стирол використовують у виробництві полістиролу (пінопласту) за допомогою полімеризації вихідної речовини. Останній широко застосовують у будівництві: як тепло-і звукоізолюючий, електроізоляційний матеріал. Нафталін, як і бензол, бере участь у виробництві пестицидів, барвників, антибіотиків. Крім того, він використовується в хімічній промисловості для отримання багатьох органічних сполук. Антрацен також застосовують у виготовленні барвників. Флуорен грає роль стабілізатора полімерів. Фенантрен, як і попередня речовина та багато інших ароматичних вуглеводнів, — один із компонентів барвників. Толуол широко застосовують у хімічній промисловості для добування органічних речовин, а також для одержання вибухівки.

Характеристика та використання речовин, що видобуваються за допомогою ароматичних вуглеводнів
До таких насамперед можна віднести продукти розглянутих хімічних реакцій бензолу. Хлорбензол, наприклад, є органічним розчинником, також використовується у виробництві фенолу, пестицидів, органічних речовин. Нітробензол є компонентом полірувальних засобів для металу, застосовується при виготовленні деяких барвників та ароматизаторів, може грати роль розчинника та окислювача. Гексахлорциклогексан використовується як отрута для боротьби з комахами-шкідниками, а також у хімічній промисловості. Циклогексан застосовують у виробництві лакофарбових виробів, при отриманні багатьох органічних сполук, у фарамацевтичній галузі промисловості.

Висновок
Прочитавши цю статтю, можна дійти невтішного висновку, що це ароматичні вуглеводні мають однотипну хімічну структуру, що дозволяє об'єднати в один клас сполук. Крім того, їх фізичні та хімічні властивості також дуже схожі. Зовнішній вигляд, температури кипіння та плавлення всіх хімічних речовин цієї групи не сильно відрізняються. Своє застосування багато ароматичних вуглеводнів знаходять в одних і тих же галузях промисловості. Речовини, які можна отримати внаслідок реакцій галогенування, нітрування, гідрування також мають схожі властивості і використовуються в схожих цілях.
Фізичні властивості
Бензол та його найближчі гомологи – безбарвні рідини зі специфічним запахом. Ароматичні вуглеводні легші за воду і в ній не розчиняються, проте легко розчиняються в органічних розчинниках – спирті, ефірі, ацетоні.
Бензол та його гомологи самі є добрими розчинниками для багатьох органічних речовин. Всі арени горять коптючим полум'ям через високий вміст вуглецю в їх молекулах.
Фізичні властивості деяких аренів представлені у таблиці.
Таблиця. Фізичні властивості деяких аренів
|
Назва |
Формула |
t°.пл., |
t°.кип., |
|
Бензол |
C 6 H 6 |
5,5 |
80,1 |
|
Толуол (метилбензол) |
З 6 Н 5 СH 3 |
95,0 |
110,6 |
|
Етилбензол |
З 6 Н 5 З 2 H 5 |
95,0 |
136,2 |
|
Ксилол (диметилбензол) |
З 6 Н 4 (СH 3) 2 |
||
|
орто- |
25,18 |
144,41 |
|
|
мета- |
47,87 |
139,10 |
|
|
пара- |
13,26 |
138,35 |
|
|
Пропілбензол |
З 6 Н 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
Кумол (ізопропілбензол) |
C 6 H 5 CH(CH 3) 2 |
96,0 |
152,39 |
|
Стирол (вінілбензол) |
З 6 Н 5 CH=СН 2 |
30,6 |
145,2 |
Бензол - легкокипляча ( tстос= 80,1°С), безбарвна рідина, що не розчиняється у воді
Увага! Бензол – отрута, діє нирки, змінює формулу крові (при тривалому впливі), може порушувати структуру хромосом.
Більшість ароматичних вуглеводнів небезпечні для життя, токсичні.
Одержання аренів (бензолу та його гомологів)
В лабораторії
1. Сплавлення солей бензойної кислоти із твердими лугами
C 6 H 5 -COONa + NaOH t → C 6 H 6 + Na 2 CO 3
бензоат натрію
2. Реакція Вюрца-Фіттінга: (тут Г - галоген)
З 6H 5 -Г+2Na + R-Г →C 6 H 5 - R + 2 NaГ
З 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
У промисловості
- виділяють з нафти та вугілля методом фракційної перегонки, риформінгом;
- з кам'яновугільної смоли та коксового газу
1. Дегідроциклізацією алканівз числом атомів вуглецю більше 6:
C 6 H 14 t , kat→C 6 H 6 + 4H 2
2. Тримеризація ацетилену(тільки для бензолу) – нар. Зелінського:
3С 2 H 2 600°C, Акт. вугілля→C 6 H 6
3. Дегідруваннямциклогексану та його гомологів:
Радянський академік Микола Дмитрович Зелінський встановив, що бензол утворюється із циклогексану (дегідрування циклоалканів
C 6 H 12 t, kat→C 6 H 6 + 3H 2

C 6 H 11 -CH 3 t , kat→C 6 H 5 -CH 3 + 3H 2
метилциклогексантолуол
4. Алкілювання бензолу(Отримання гомологів бензолу) – р Фріделя-Крафтса.
C 6 H 6 + C 2 H 5 -Cl t, AlCl3→C 6 H 5 -C 2 H 5 + HCl
хлоретан етилбензол

Хімічні властивості аренів
I. РЕАКЦІЇ ОКИСЛЕННЯ
1. Горіння (копче полум'я):
2C 6 H 6 + 15O 2 t→12CO 2 + 6H 2 O + Q
2. Бензол за звичайних умов не знебарвлює бромну воду та водний розчин марганцівки
3. Гомологи бензолу окислюються перманганатом калію (знебарвлюють марганцівку):
А) у кислому середовищі до бензойної кислоти
При впливі на гомологи бензолу перманганату калію та інших сильних окислювачів бічні ланцюги окислюються. Яким би складним не був ланцюг заступника, він руйнується, за винятком a-атома вуглецю, який окислюється в карбоксильну групу.
Гомологи бензолу з одним боковим ланцюгом дають бензойну кислоту:
Гомологи, що містять два бічні ланцюги, дають двоосновні кислоти:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 +28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
Спрощено :
C 6 H 5 -CH 3 + 3O KMnO4→C 6 H 5 COOH + H 2 O
Б) у нейтральній та слаболужній до солей бензойної кислоти
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COOК + K ВІН + 2MnO 2 + H 2 O
II. РЕАКЦІЇ ПРИЄДНАННЯ (важче, ніж у алкенів)
1. Галогенування
C 6 H 6 +3Cl 2 h ν → C 6 H 6 Cl 6 (гексахлорциклогексан – гексахлоран)
2. Гідрування
C 6 H 6 + 3H 2 t , PtабоNi→C 6 H 12 (циклогексан)
3. Полімеризація
III. РЕАКЦІЇ ЗАМІЩЕННЯ - Іонний механізм (легше, ніж у алканів)
1. Галогенування -
a ) бензолу
C 6 H 6 + Cl 2 AlCl 3 → C 6 H 5 -Cl + HCl (хлорбензол)
C 6 H 6 + 6Cl 2 t ,AlCl3→C 6 Cl 6 + 6HCl( гексахлорбензол)
C 6 H 6 + Br 2 t,FeCl3→ C 6 H 5 -Br + HBr( бромбензол)
б) гомологів бензолу при опроміненні або нагріванні
За хімічними властивостями алкільні радикали подібні до алканів. Атоми водню у яких заміщаються на галоген по свободно-радикальному механізму. Тому відсутність каталізатора при нагріванні або УФ-опроміненні йде радикальна реакція заміщення в бічному ланцюгу. Вплив бензольного кільця на алкільні заступники призводить до того, що завжди заміщається атом водню у атома вуглецю, безпосередньо пов'язаного з бензольним кільцем (a -атома вуглецю).
1) C 6 H 5 -CH 3 + Cl 2 h ν → C 6 H 5 -CH 2 -Cl + HCl
в) гомологів бензолу у присутності каталізатора
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (суміш орту, пара похідних) +HCl
2. Нітрування (з азотною кислотою)
C 6 H 6 + HO-NO 2 t, H2SO4→C 6 H 5 -NO 2 + H 2 O
нітробензол - запах мигдалю!
C 6 H 5 -CH 3 + 3HO-NO 2 t, H2SO4→ З H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2,4,6-тринітротолуол (тол, тротил)
Застосування бензолу та його гомологів
Бензол C 6 H 6 – добрий розчинник. Бензол як добавка покращує якість моторного палива. Служить сировиною для отримання багатьох ароматичних органічних сполук - нітробензолу C 6 H 5 NO 2 (розчинник, з нього одержують анілін), хлорбензолу C 6 H 5 Cl, фенолу C 6 H 5 OH, стиролу і т.д.
Толуол C 6 H 5 -CH 3 - розчинник, використовується при виробництві барвників, лікарських та вибухових речовин (тротил (тол), або 2,4,6-тринітротолуол ТНТ).
Ксилоли C 6 H 4 (CH 3) 2 . Технічний ксилол – суміш трьох ізомерів ( орто-, мета- І пара-ксилолів) – застосовується як розчинник і вихідний продукт для синтезу багатьох органічних сполук.
Ізопропілбензол C 6 H 5 -CH(CH 3) 2 служить для отримання фенолу та ацетону.
Хлорпохідні бензолувикористовують для захисту рослин. Так, продукт заміщення в бензол атомів Н атомами хлору - гексахлорбензол С 6 Сl 6 - фунгіцид; його застосовують для сухого протруювання насіння пшениці та жита проти твердої сажки. Продукт приєднання хлору до бензолу – гексахлорциклогексан (гексахлоран) С6Н6Сl6 – інсектицид; його використовують для боротьби зі шкідливими комахами. Згадані речовини відносяться до пестицидів – хімічних засобів боротьби з мікроорганізмами, рослинами та тваринами.
Стирол C 6 H 5 – CH = CH 2 дуже легко полімеризується, утворюючи полістирол, а співполімеризуючись з бутадієном – бутадієнстирольні каучуки.
ВІДЕО-ДОСВІТИ
АРЕНИ
Ароматичні вуглеводні (арени) – циклічні вуглеводні, що об'єднуються поняттям ароматичності, що обумовлює загальні ознаки у будові та хімічних властивостях.
Класифікація
За кількістю бензольних кілець у молекулі арени поділяютьсяна:
моноядерні
багатоядерні

Номенклатура та ізомерія
Структурним родоначальником вуглеводнів бензольного ряду служить бензол З 6 Н 6від якого будуються систематичні назви гомологів.
Для моноциклічних сполук зберігаються такі несистематичні (тривіальні) назви:

Положення заступників вказують найменшими цифрами (напрямок нумерації не має значення),
|
|
|
а для ді заміщених з'єднань можна використовувати позначення орто, мета, пара.
|
|
|
|
Якщо у кільці три заступники тоні мають отримати найменші номери, тобто. ряд "1,2,4" має перевагу перед "1,3,4".


1,2-диметил-4-етилбензол (вірна назва) 3,4-диметил-1-етилбензол (невірно)
Ізомерія монозаміщених аренів обумовлена будовою вуглецевого скелета заступника, у ди-і полізаміщених гомологів бензолу додається ще ізомерія, викликана різним розташуванням замісників в ядрі.
Ізомерія ароматичних УВ складу З 9 Н 12:
|
|
|
|
|
Фізичні властивості
Температури кипіння та плавлення у аренів вище, ніж у алканів, алкенів, алкінів, малополярні, не розчиняються у воді і добре розчиняються в неполярних органічних розчинниках. Арени – це рідини або тверді речовини, що мають специфічні запахи. Бензоли та багато конденсованих арен токсичні, деякі з них виявляють концерогенні властивості. Проміжними продуктами окислення конденсованих аренів в організмі є епоксиди, які або самі викликають рак, або є попередниками канцерогенів.
Отримання аренів
Багато ароматичних УВ мають важливе практичне значення та виробляються у великому промисловому масштабі. Ряд промислових методів заснований на переробці вугілля та нафти.
Нафта складається головним чином з аліфатичних та аліциклічних УВ, для перетворення аліфатичних або ациклічних УВ на ароматичні розроблені способи ароматизації нафти, хімічні основи яких розвинені Н.Д. Зелінським, Б.А. Казанським.
1. Циклізація та дегідрування:
2. Гідродеметилування:

3. Гомологи бензолу отримують шляхом алкілування або ацилування з подальшим відновленням карбонільної групи.
а) Алкілювання за Фріделем-Крафтсом:

б) Ацилювання за Фріделем-Крафтсом:

4. Одержання біфеніла за реакцією Вюрца-Фітинга:
5. Одержання дифенілметану за реакцією Фріделя-Крафтса:
Будова та хімічні властивості.
Критерії ароматичності:
На підставі теоретичних розрахунків та експериментального вивчення циклічних сполучених систем було встановлено, що сполука ароматична, якщо вона має:
- Плоский циклічний σ-скелет;
- Сполучену замкнуту π-електронну систему, що охоплює всі атоми циклу і містить 4n + 2 де n = 0, 1, 2, 3 і т.д. Це формулювання відоме, як правило Хюккеля.Критерії ароматичності дозволяють відрізняти пов'язані ароматичні системи від усіх інших. Бензол містить секстет π-електронів та відповідає правилу Хюккеля при n = 1.

Що дає ароматичність:
Незважаючи на високий рівень ненасиченості, ароматичні сполуки стійкі до дії окислювачів і температури, вони схильні вступати в реакції заміщення, а не приєднання. Ці сполуки мають підвищену термодинамічну стабільність, що забезпечується високою енергією сполучення ароматичної системи кільця (150 кДж/моль), тому арени переважно вступають у реакції заміщення, в результаті чого зберігають ароматичність.
Механізм реакцій електрофільного заміщення в ароматичному кільці:
Електронна щільність π-сполученої системи бензольного кільця є зручним об'єктом для атаки електрофільними реагентами.
Як правило, електрофільні реагенти генеруються в процесі реакції за допомогою каталізаторів та відповідних умов.
Е - Y → E δ + - Y δ - → E + + Y -
Утворення π-комплексу.Початкова атака електрофілом π-електронної хмари кільця призводить до координації реагенту з π-системою та утворення комплексу донорно-акцепторного типу званого π-комплексу.Ароматична система не порушується:

Утворення σ-комплексу.Лімітує стадія, на ній електрофіл утворює ковалентний зв'язок з атомом вуглецю за рахунок двох електронів π-системи кільця, що супроводжується переходом даного атома вуглецю з sp 2 -в sp 3 -гібридний стан і порушенням ароматичної, молекула перетворюється на карбокатіон.

Стабілізація σ-комплексу. Здійснюється шляхом відщеплення від σ-комплексу протона за допомогою основи. При цьому за рахунок двох електронів ковалентного зв'язку, що розривається, С – Н відновлюється замкнута π-системи кільця, тобто. відбувається повернення молекули в ароматичний стан:

Вплив заступників на реакційну здатність та орієнтацію електрофільного заміщення
Заступники у бензольному кільці порушують рівномірність у розподілі π- електронної хмари кільця і цим впливають на реакційну здатність кільця.
- Електронодонорні заступники (Д) підвищують електронну щільність кільця та збільшують швидкість електрофільного заміщення, такі заступники називають активуючими.
- Електроноакцепторні заступники (А) знижують електронну щільність кільця та зменшують швидкість реакції, називаються дезактивуючими.